Por Samanta Adam
Introducción
El control de productos de degradación en productos farmacéuticos sigue siendo una tarea desafiante entre los científicos del sector farmacéutico.
Se utiliza la guía de degradación forzada recomendada por la Conferencia Internacional de Armonización (ICH) para identificar los posibles productos de degradación, que se forman durante la degradación por estrés, pero que en realidad se forman en una sustancia farmacológica o en el Producto, debido a las condiciones de almacenamiento durante su vida útil. Esta información ayuda a científicos a diseñar medidas apropiadas para minimizar las impurezas esperadas en el ciclo de vida de los productos farmacéuticos.
Las pruebas de estrés (estudio de degradación forzada) se han convertido en un importante requisito regulatorio fundamental para el desarrollo de fármacos y proceso de aprobación. Proporciona evidencia sobre el impacto de diversos factores ambientales sobre la calidad del fármaco, sustancias o productos farmacéuticos en tiempo real y son las bases científicas las que pueden recomendar las condiciones de almacenamiento y la tecnología del paquete para una forma farmacéutica. En la investigación analítica farmacéutica, el diseño de las condiciones de estrés es crucial y el paso preliminar en la realización de estudios de estabilidad para el fármaco o producto, porque revela el mecanismo intrínseco del fármaco y la descomposición junto con la información relativa al porcentaje de degradación y número de impurezas que se esperan en el ciclo de vida del medicamento.
En la literatura (Brattty M., 2020) también podemos encontrar que se realizan estudios de degradación forzada utilizando un reactivo químico o un inductor de estrés en cada tipo de condición de estrés que incluyen: hidrólisis ácida y básica, oxidación y fotólisis.
Reacciones de oxidación
Los radicales libres como los que se generan del peróxido de hidrógeno y el oxígeno singulete pueden oxidar los fármacos. La oxidación implica la pérdida de electrones y puede degradar la estructura del fármaco.
Los radicales libres se forman normalmente como subproducto del metabolismo de oxígeno en animales y plantas. Los fármacos, cuando se metabolizan, pueden producir radicales libres. La luz puede oxidar los fármacos y acelerar su degradación (Kryczyk-Poprawa A., 2020).
Una de las reacciones típicas que se pueden presentar en las estructuras de los fármacos son las siguientes:
-Formación de Epóxidos
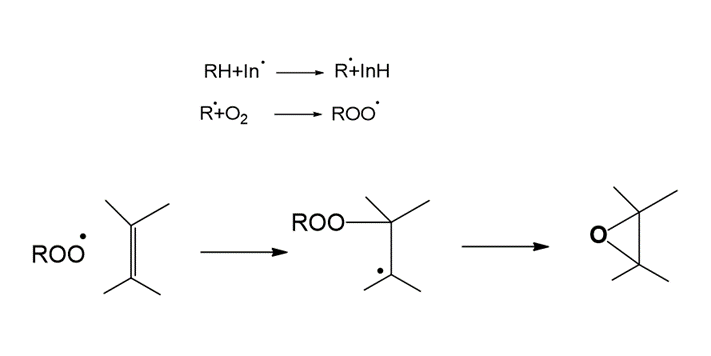
Figura 1. Mecanismo de reacción general de la formación de un Epóxido.
Para la formación del epóxido, el radical libre ataca el doble enlace en la molécula, generando un radical terciario, el cual da paso a la formación del Epóxido.
Por ejemplo, la formación del Epóxido en la molécula de Tetrazepam.
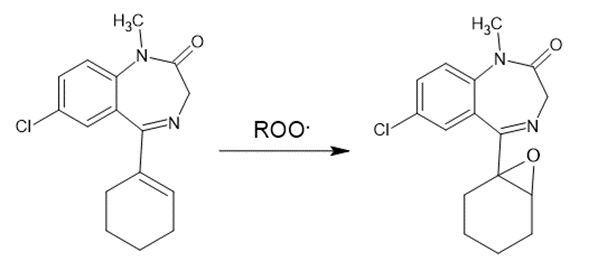
Figura 2. Oxidación de Tetrazepam.
-Formación de N-Óxidos
Las aminas terciarias se oxidan en presencia de agentes oxidantes para formar N-Óxidos.
Por ejemplo, la formación del N-Óxido en la oxidación de la molécula de Pantoprazol (Bratty M., 2020).
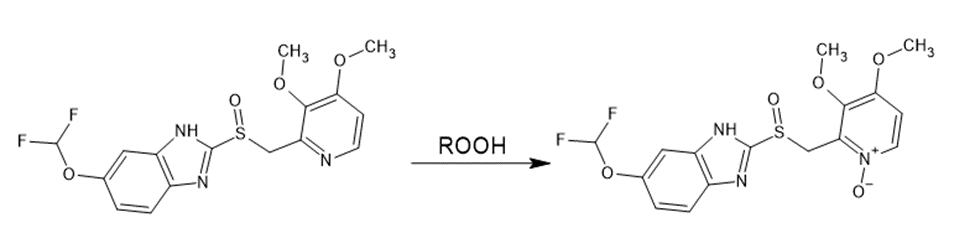
Figura 3. Oxidación de Pantoprazol.
-Oxidación de Alcoholes.
Los alcanos se pueden oxidar a alcoholes y éstos a su vez se pueden oxidar a aldehídos o cetonas. La oxidación ocurre conjuntamente con la pérdida de una molécula de Hidrógeno. Es por esto que aquellos carbonos que no tengan hidrógenos no pueden ser oxidados, ya que, no tienen hidrógenos enlazados para perder.
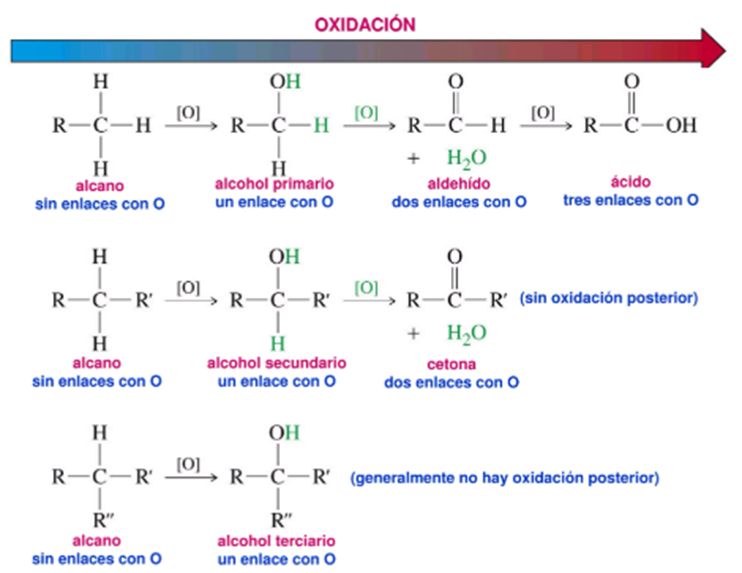
Figura 4. Oxidación de alcoholes.
Por ejemplo, la oxidación de la molécula de Dexametasona, donde en un primer paso se oxida el alcohol primario hasta liberar una molécula de CO2, posteriormente el aldehído resultante se oxida hasta liberar la segunda molécula de CO2 y finalmente formar la cetona correspondiente (Ummiti K., 2014).
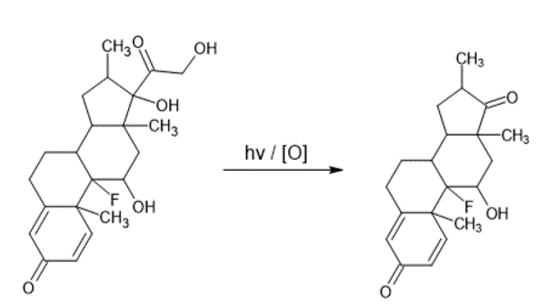
Figura 5. Oxidación de Dexametasona.
¿Cómo prevenir la degradación de los fármacos?
-Contenedores herméticos:
Almacenar los fármacos en contenedores herméticos puede prevenir la exposición a la luz y al aire, evitando así la oxidación del fármaco y la formación de radicales libres.
-Ambiente seco:
El almacenamiento de los fármacos en un ambiente seco puede prevenir la hidrólisis y la oxidación de estos.
-Antioxidantes:
La adición de antioxidantes en la formulación del fármaco puede prevenir la oxidación de estos, por ejemplo, Sulfito de sodio, Metabisulfito de sodio, Tiosulfato de Sodio, Ácido Ascórbico, Palmitato de ascorbilo (AP), Galato de propilo (PG), Hidroxitolueno butilado (BHT), Hidroxianisol butilado (BHA), Alfa-tocoferol (α-TOH), Ácido Tartárico, Ácido Cítrico, Ácido etilendiaminotetraacético (EDTA), etc (Zuñiga S., 2021).
Bibliografía
- FDA Guidance for Industry (2003), INDs for Phase II and III Studies –Chemistry, Manufacturing, and Controls Information, Food and Drug Administration. https://www.fda.gov/drugs.
- International Conference on Harmonization, ICH Q2 Guidelines (2003), Available from: http://www.fda.gov/downloads/RegulatoryInformation/Guidances/ucm128204.pdf.
- Bratty M., Thangavel N., Peraman R., Kumar V. (2019). HPLC–DAD Method for Investigating Pantoprazole for its Stress-Dependent Degradation by Photolysis and Oxidation. Acta Chromatographic 32(2020)4, 247–255.
- Kryczyk-Poprawa A., Kwiecién A., Opoka W., (2019). Photostability of Topical Agents Applied to the Skin:A Review. Pharmaceutics 2020, 12, 10; doi:10.3390/pharmaceutics12010010.
- Ummiti K., Vakkala S., Panuganti V., Reddy M. (2014). ISOLATION, IDENTIFICATION, AND
CHARACTERIZATION OF 17-OXODEXAMETHASONE, AN OXIDATIVE DEGRADATION IMPURITY OF DEXAMETHASONE USING FLASH CHROMATOGRAPHY AND NMR/HRMS/IR. Journal of Liquid Chromatography & Related Technologies, 37:17, 2403-2419.
- Zuñiga S, Paulina S., (2021). Revisión de antioxidantes más utilizados en formulación farmacéutica disponibles en el mercado. https://repositorio.xoc.uam.mx/jspui/handle/123456789/38105
