Por Susana Franco
Un método analítico es una secuencia de pasos que nos permite tener a nuestra muestra en las condiciones necesarias para obtener información acerca de su composición, estructura, y/o propiedades; dicho método se puede clasificar según el tipo de análisis que se realiza, como cualitativo o cuantitativo; también por el tipo de técnica analítica empleada para determinar las características de dicha muestra, las cuales pueden ser espectrofotométricas, cromatográficas, microbiológicas, electroquímicas entre otras.
Uno de los retos más importantes que se presentan al desarrollar un método analítico para cuantificar impurezas con HPLC es el de contar con moléculas que tienen pocos grupos cromóforos. Los grupos cromóforos son aquellos que absorben la radiación electromagnética en el rango visible o ultravioleta. La absorción de radiación es el principio físico que permite detectar y medir los componentes separados por HPLC mediante un detector UV-VIS. Cuando una molécula tiene pocos grupos cromóforos, significa que tiene una baja absorción de radiación, lo que dificulta su detección y cuantificación.
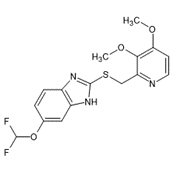
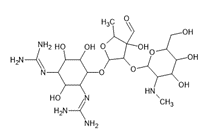
Fig. 1 Molécula con varios grupos cromóforos Vs Molécula con pocos grupos cromóforos.
¿Qué hago cuando tengo una molécula que tiene pocos grupos cromóforos?
Para superar el reto de contar con moléculas que tienen pocos grupos cromóforos, se han propuesto varias estrategias que al ser sumadas te pueden apoyar en el desarrollo de un método analítico. Primero veremos las estrategias que puedes hacer con el diseño de la técnica analítica y después aquellas que pueden modificar a tu analito.
Diseño de técnica analítica
Reactivos: Verifica que la longitud de corte de tus reactivos no interfiera con la de tu analito, recuerda que es la longitud de onda en la cual el disolvente absorbe una porción significativa de la luz, causando una pérdida de la señal e inhabilidad para ejecutar un análisis. En este punto tendrás que evaluar si te conviene perder absortividad, pero evitar interferencias o si es el caso contrario. Si este último es tu caso, evalúa el comprar reactivos, grado MASAS.
pH de la fase móvil: En este punto es importante que asegures que al pH de trabajo tengas al 100% de tu analito, en el caso de métodos de impurezas en las cuales desconoces la estructura es importante que realices pruebas de pH conforme a los pKa de tu analito madre. Lo anterior, no va a contribuir a que tengas más grupos cromóforos, pero sí a que puedas ver a tu analito al 100% y no al 75%.
Concentra tu muestra:
Primera opción: Conoce la solubilidad de tu molécula de interés y tus excipientes, puesto que debes de realizar una mezcla en la cual puedas solubilizar a tu analito, pero evites solubilizar a algún excipiente que te produzca alguna interferencia.
Segunda opción: Aumentar el volumen de inyección, en este caso debes tener en cuenta dos aspectos: el primero es la limpieza del inyector, por lo cual, es importante que evites el uso de septo prearinado y consideres tener viales de lavado. El segundo aspecto está relacionado con la saturación de tu columna, por lo cual es recomendable el uso de precolumna y realizar lavados consecutivos entre corridas.
Tercera opción: La extracción en fase sólida (SPE) es una técnica de preparación de muestras, permite la extracción, limpieza y concentración de analitos antes de su cuantificación.
Limpieza de la muestra: Centrifugar tu muestra y realizar pruebas con los diferentes tipos de filtros de jeringa, ya que algunos podrían no ser efectivos.
Fase estacionaria: La selección de la fase estacionaria correcta evitará que los picos que se obtengan estén coleados, anchos o tengan un fronteo. Por lo anterior, será indispensable que dentro de tus parámetros establecidos en adecuabilidad incluyan eficiencia de la columna.
Parámetros del equipo:
Es esencial que, antes de llevar a cabo estos cambios, consulte con el técnico de servicio, ya que podría variar los nombres en función de la marca y modelo de equipo HPLC, y esté te proporcionará información sobre los parámetros adecuados y el uso de estos.
Auto cero: Tomará como blanco el espectro del eluyente.
Velocidad de muestreo: Muy pocos puntos de muestreo dan como resultado inconsistencias en áreas y en alturas.
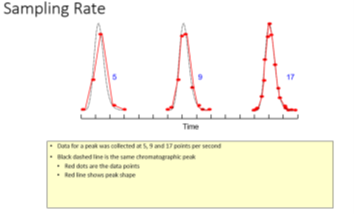
Fig. 2 Velocidad de muestreo5
Constante de tiempo: Ayuda a lograr una buena señal-ruido al filtrar el ruido de alta frecuencia, sin embargo, si esta constante de tiempo es demasiado alta, dará como resultado picos distorsionados.
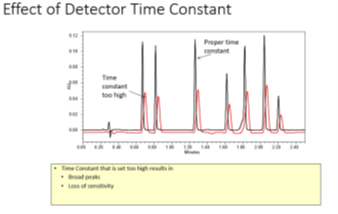
Fig. 3 Constante de tiempo5
Ruido + Solvente: Este parámetro no es recomendable moverlo; sin embargo, si se tiene una línea base muy ruidosa y poca absortividad de la molécula de interés, se pueden obtener picos que no cumplan con pureza, por lo cual deberás hacer los pasos marcados por el proveedor de servicio para que este cálculo con este movimiento sea el correcto.
Modificación del analito
Las estrategias que modifican la molécula consisten en alterar la estructura química o física de la molécula para aumentar su absorción de radiación.
La derivatización: Consiste unir grupos cromóforos en la molécula de interés mediante una reacción química previa o posterior a la separación por HPLC.
En este parámetro debes de tener cuidado con la estabilidad de tu muestra. Asegurar que el equipo cromatográfico pueda hacer la función de toma de muestra y toma del derivatizante y mezclado si se trata de una reacción química previa. Si la reacción es posterior, debes de verificar que cuentes con los aditamentos necesarios y espacio antes de llegar al detector.
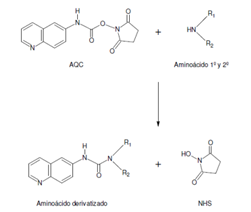
Fig. 4 Derivatización3
La complejación: Radica en formar un complejo con otra sustancia que tenga mayor absorción de radiación.
La ionización: que consiste en modificar el estado de carga de la molécula mediante un cambio de pH o un aditivo iónico. Por ejemplo, se puede ionizar una amina con ácido clorhídrico para formar un catión amonio que tenga mayor absorción UV.
¿Qué hago cuando ya implementé todo lo anterior?
Difícilmente caerás en este punto, pero si las modificaciones anteriores no te brindaron los resultados que esperabas, puedes plantearte emplear un método de masas. Sin embargo, tienes que contemplar que cuando se trate de un método de impurezas desconocidas, tendrás que elucidar su estructura molecular. Para lo cual, es recomendable partir desde la estructura base de tu analito principal. Los cambios de voltaje de capilar deberán ser adecuados, ya que uno muy elevado con moléculas lábiles podría ocasionar que se fragmente desde el principio.
Bibliografía
- Ávila-Camacho, F. J., Moreno-Villalba, L. M., Cerón-Montes, G. I., Garrido-Hernández, A., Cardoso-Chávez, C. A., & Pacheco-Piña, C. J. (2021). Diseño de un espectrofotómetro UV-VIS de bajo costo para la industria bioquímica: Una Revisión. Pädi Boletín Científico De Ciencias Básicas E Ingenierías Del ICBI, 9(Especial2), 19-28. https://doi.org/10.29057/icbi.v9iEspecial2.778
- Fábio R. P. RochaI,*; Leonardo S. G. TeixeiraII, Estratégias para aumento de sensibilidade em espectrofotometria UV-VIS IInstituto de Química, Universidade de São Paulo, CP 26077, 05513-970 São Paulo – SP IIDepartamento de Engenharia e Arquitetura, Universidade Salvador, Av. Cardeal da Silva, 132, 40220-141 Salvador – BA, Divulgação • Quím. Nova 27 (5) • Out 2004 • https://doi.org/10.1590/S0100-40422004000500021
- Amézquita L. Fernando, Mendoza O. Diana, Curso Básico de Espectroscopía Ultravioleta -visible. Universidad de Guanajuato Facultad de Química.
- How do you set up the Purity Thresholds in Empower 3? – WKB11215, Waters Knowledge Base
- Setting the Sampling Rate and Time Constant in Empower – Tip207, Waters Knowledge Base.
